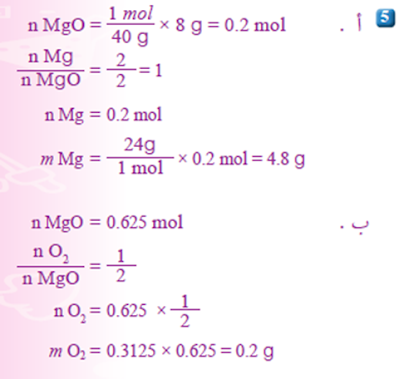مراجعة الوحدة الرابعة التفاعلات والحسابات الكيميائية صفحة 39
المول: عدد
أفوجادرو من الذرات أو الأيونات أو الجزيئات.
الكتلة الجزيئية: مجموع
الكتل الذرية للذرات الموجودة في الجزيء الذي تريبط ذراته بروابط تساهمية مقيسة
بوحدة .amu
تفاعل التحلل: تحلل
مركب واحد بالحرارة أو الكهرباء أو الضوء؛ منتجا مادتين أو أكثر، وقد تكون النواتج
عناصر أو مركبات.
المردود المئوي للتفاعل: النسبة المئوية للمردود الفعلي إلى المردود النظري.
2- أكتبُ معادلةً كیمیائیةً موزونةً تمثلُ:
أ . تفاعلَ عنصرِ الحدیدِ الصلبِ معَ غازِ الأكسجینِ لإنتاجِ أكسیدِ الحدیدِ ( III ) الصلبِ.
ب. تفاعلَ كربوناتِ الكالسیومِ الصلبةِ معَ محلولِ حمضِ الھیدروكلوریكِ لإنتاجِ كلوریدِ الكالسیومِ الصلبِ وغازِ ثاني أكسیدِ الكربونِ والماءِ السائلِ.
ج. تفاعلَ أیوناتِ الفضةِ معَ أیوناتِ البرومیدِ؛ لتكوینِ راسبٍ منْ برومیدِ الفضةِ.
الإجابة:
4Fe(s) + 3O2(g) → 2Fe2O3(s)
CaCO3(s) + 2HCl(aq) → CaCl2(s) + CO2(g) + H2O(1)
Ag+ (aq) +
Br- (aq) → AgBr(s)
3- أستنتجُ الصیغةَ الأولیةَ للمركبِ الناتج من تفاعلُ 0.6 g منَ الكربونِ معَ الأكسجینِ لتكوینِ 2.2 g منْ أكسیدِ الكربون.
الإجابة:
0.05 C = 0.6
g /12 g =
O = 1.6 g/16 g =
0.1
بالقسمة على أصغر رقم فإن
C = 1 , O = 2
وبذلك تكون الصيغة الأولية هي:2 CO
4- أستنتجُ الصیغةَ الجزیئیةَ لمركبٍ صیغتُه الأولیةُ CH2 وكتلتُه المولیةُ 28 g .
الإجابة:
مجموع كتلة الصيغة الأولية يساوي 14 g بقسمة
الكتلة المولية على كتلة الصيغة الأولية على عدد مضاعفات الصيغة الأولية، كما يأتي:
`\frac{28}{14}=2`
5- یحترقُ عنصرُ المغنسیومِ وفقَ المعادلةِ الآتیةِ:
2Mg(s) + O2(g) → 2MgO(s)
أ . أحسبُ كتلةَ المغنیسیومِ اللازمةَ لإنتاجِ 8 g منْ أكسیدِ المغنیسیوم.
ب.أحسبُ كتلةَ الأكسجینِ اللازمةَ لإنتاجِ 20 g منْ أكسیدِ المغنیسیومِ.
6- أحسبُ عددَ المولاتِ في 9.8 g منْ حمضِ الكبریتیكِ H2SO4
الإجابة:
الكتلة المولية للحمض تساوي 98 g/mol
`n=\frac m{Mr}=\frac{9.8g}{98g/mol}=0.1mol`
7- تتحللُ كربوناتُ الكالسیومِ بالحرارةِ وفقَ المعادلةِ الآتیةِ:
CaCO3(s)
فإذا علمتُ أنَّ الكتلَ الذریةَ (C = 12, O =
16, Ca = 40)
أ . أحسبُ كتلةَ أكسیدِ الكالسیومِ الناتجةَ منْ تسخینِ 50 g منْ كربوناتِ الكالسیومِ.
ب.أحسبُ المردودَ المئويَّ للتفاعلِ إذا حصلْنا على 15 g فقطْ منْ أكسیدِ الكالسیومِ.
الإجابة:
أ. 28g
ب. 54% تقريبًا
8- كربیدُ السیلكونِ SiC مادةٌ قاسیةٌ تستخدمُ في صناعةِ ورقِ الزجاجِ وحجرِ الجلخِ، ویتمُّ الحصولُ علیه منْ تسخینِ أكسیدِ السیلكونِ معَ الكربونِ وفقَ المعادلةِ:
SiO2(s) + C(s) → SiC(s) + CO(g)
فإذا عُلِمَ أنَّ الكتلَ الذریةَ للعناصرِ المذكورةِ كالآتي
(C = 12, O = 16, Si = 28)
أ . أوازنُ معادلةَ التفاعلِ.
ب.أحسبُ عددَ مولاتِ CO الناتجةِ منْ تفاعلِ 0.5 mol منْ SiO2
ج.أحسبُ كتلةَ SiC الناتجةَ عنْ تفاعلِ 4 mol منْ ذراتِ الكربونِ.
د . أحسبُ النسبةَ المئویةَ لعنصرِ الكربونِ في المركبِ .SiC
الإجابة:
أ. SiO2(s)+3C(s)→SiC(s)+2CO(g)
ب. 1mol
ج. 30%
9- أصنفُ المعادلاتِ الآتیةَ حسبَ أنواعِھا: (اتحادٍ، أوْ تحللٍ، أوْ إحلالٍ أحاديٍّ):
2Al(s) +
3Cl2(g) → 2AlCl3(s)
Mg(s) + CuSO4(aq)
→ Cu(s) + MgSO4(aq)
CdCO3(s) Δ→CdO(s) +
الإجابة: على الترتيب: اتحاد ، إحلال أحادي ،
تحلل
10- أختارُ رمزَ الإجابةِ الصحیحةِ في كلٍّ ممّا یأتي:
1. ما عددُ مولاتِ ذراتِ الأكسجینِ الموجودةِ في 1 mol منْ ؟AgNO3
أ . 1 ب. 2 ج. 3 د. 4
2. أيٌّ منَ الآتیةِ یعدُّ الكتلةَ المولیةَ لمركبِ Na2SO4 بوحدةِ ؟(g /mol
أ . 71 ب. 119 ج. 142 د. 183
3. تُسمّى كمیةُ المادةِ الناتجةِ المحسوبةُ منَ التفاعلِ:
أ . المردودَ المتوقعَ. ب. المردودَ الفعليَّ. ج. الكتلةَ المولیةَ. د . المولَ.
الإجابة:
1. ج
2. ج
3. أ
11- أمیزُ التفاعلاتِ الواردةَ في النماذجِ الآتیةِ وأفسرُھا:
الإجابة:
A. اتحاد (مادتان تنتجان
مادة واحدة(.
b. تحلل (مادة واحدة تنتج
مادتين(.
c. احلال أحادي (استبدال ذرة محل ذرة(
12- مركبٌ كتلته 8.8 g یتكونُ فقطْ منْ عنصري الكربونِ والھیدروجینِ، وكتلةُ الھیدروجینِ: 1.6 g
أ .أحسبُ النسبةَ المئویةَ بالكتلةِ لعنصري الكربونِ والھیدروجینِ في المركبِ.
ب.أستنتجُ: أيُّ الصیغتیْنِ تمثلُ المركبَ C3H8
أم C2H6
أ.
c%=81, H%=18.2
ب.
C3H8